تصفیه فاضلاب آبکاری
تصفیه فاضلاب آبکاری
تصفیه فاضلاب آبکاری به روش شیمیایی ب روش ترسیب و انعقاد شیمیایی قابل انجام می باشد. فاضلاب توليدي آبکاری ها حاوي دامنه وسيعي از آلاينده هاي شيميايي است. اين آلاينده ها شامل فلزات سنگین ، پسماندهاي آلي، جامدات معلق، سيانيد، فسفات، فلورايد و آمونياك هستند. آمونياك كه معمولاً داراي غلظت پاييني است، عمدتاً با فلزات و سيانيد مخلوط مي گردد. اگر غلظت آمونياك بالا باشد ، بايستي كنترل گردد. زيرا باعث ايجاد اختلال در فرايند حذف فلزات مي گردد. سيانيد ، فسفات و فلورايد جزء تركيباتي هستند كه داراي اثرات قابل توجهي در محيط زيست هستند. جامدات معلق يك پارامتر معمول در كنترل عملكرد تصفيه خانه در حذف مواد سمي آلي و معدني و تخليه پساب به محيط زيست است. فلزات يك گروه مهم از آلاينده ها هستند كه بالغ بر 30 فلز هسـتند.

نوع فرايند تصفيه مورد استفاده بـه خصوصـيات كيفي فاضلاب بستگي دارد. تكنولوژي هايی كه به صورت گسترده در بازيافت اينگونه فاضلاب ها بكار مي روند، عبارت از تبخير، تبـادل يـوني و بازيافت الكتروليتي هستند. كادميوم و جيوه برخی از فلزات خطرناک در پساب آبکاری مي باشند. pHبهينه براي حذف كـادميوم بسيار بالا است و بكارگيري ترسيب هيدروكسـيدي غلظـت ايـن فلـز در پساب را در حد مورد انتظار كاهش نمي دهد. جيوه در اغلب موارد به عنوان تنها آلاينده يا آلاينده اصلي فاضلاب مورد جداسازي قرار گرفته و روش هاي تصفيه مؤثري از قبيل ترسيب سولفيدي براي كنترل آن بكار مي رود.
روشهاي معمول تصفیه فاضلاب آبکاری
ترسيب هيدروكسيدي يكي از متداولترين روشهاي تصفيه فاضلاب ناشي از فرايندهاي تكميـل فلزات است. اين فرايند جهت حذف فلزات سنگين و ساير آلاينده هاي محلول و معلق از اينگونـه فاضـلاب ها بكار مي رود. اساس اين روش بر پايه حلاليت پايين هيدروكسيدهاي فلزي در دامنه pHقليايي است. بدين ترتيب با انتقال فلزات از فاز مايع به فاز جامد، با استفاده از روش هاي فيزيكي مثل ته نشيني، شناورسازي و صاف سازي از محلول جدا مي گردند. آهن، مس، روي، كادميوم، بريليوم، كبالت، جيوه، منگنز و آلومينيوم از جمله فلزاتي هستند كه به روش ترسيب هيدروكسيد حذف مي گردند. كروم فقط با ظرفيت سه قابل ترسيب است.
اين فرايند اغلب همراه با منعقد كننده هاي آلي و معدني در حذف ديگر آلاينده هاي محلول و ذره اي مؤثر است. ترسيب هيدروكسيدي در حذف بسياري از عوامل آلاينده موجود در فاضلاب صنايع پرداخت فلزات مؤثر است. بنابراين پيش تصفيه اينگونه فاضلاب ها قبل از ترسيب هيدروكسيدي لازم نيست. اين فرايند در شرايط محيطي قابل بهره برداري است. بهره برداري از آن ساده بوده و امكان كنترل آن وجود دارد. مهمترين مزيت اين فرايند هزينه هاي پايين آن به خصوص در صورت استفاده از آهك براي
تنظيم pH است.
از مهم ترين معايب اين روش، توليد مقادير زيادي لجن و متغير بودن pH بهينه حذف هر فلز است. زيرا هر فلز در pHخاصي حداقل حلاليت را دارد. حذف مطلوب يك فلز خاص باعث كاهش راندمان حذف ساير فلزات موجود در محلول مي گردد. گاهي اوقات براي حذف مؤثر كليه فلزات موجود در فاضلاب به تصفيه دو مرحله اي نياز است. از طرف ديگر، حلاليت هيدروكسيد فلزات به حد كافي پايين نيست تا بتوان كمپلكس هاي فلزات را نيز حذف نمود. علاوه بر اين، در كليه فرايندهاي ترسيب – ته نشيني، عملكرد فرايند به مرحله جداسازي جامدات بستگي دارد. از معايب ديگر اين فرايند، استفاده از آهك بـراي تنظيم pH است.
آهكي كه براي فرايند بكار ميرود بصورت دوغاب است كه مديريت آن در مراحل پمپاژ، انتقال و تزريق مشكل است. اما در مقايسه با ساير مواد قليايي اين ماده بسيار ارزان بوده و براي تصفيه هاي تكميلي فاضلاب داراي مزاياي زيادي است. حلاليت هيدروكسيدها به pH فاضلاب بستگي دارد. اين وابستگي نه تنها ناشي از غلظت يون هيدروكسيد، بلكه تا حدود زيادي ناشي از شكل گيري كمپلكس هاي هيدروكسو فلزات است. غلظت كمپلكس هاي هيدروكسو نيز به pHمحيط آبي بستگي دارد. كمپلكسهاي هيدروكسو داراي بار مثبت، منفي يا خنثي هستند. كمپلكسهاي داراي بار مثبت در pHپـايين تر غالب هستند.
مقادير pHدر اين شرايط پايينتر از pHحداقل حلاليت فلزات است.
گونه هاي داراي بار منفي در pH بالاتر غالب هستند. اما غلظت گونه هاي خنثي به pH وابسته نيست. كمپلكس هاي هيدروكسـو پليمري (چند هسته اي) حاوي بيش از يك اتم فلزي هستند. حلاليت فلزات جمع غلظت يون هاي فلزات آزاد و
كمپلكس هاي هيدراكسو است. شكل زیر نمودار حلاليت هيدروكسيدكادميوم را نشان مي دهد.
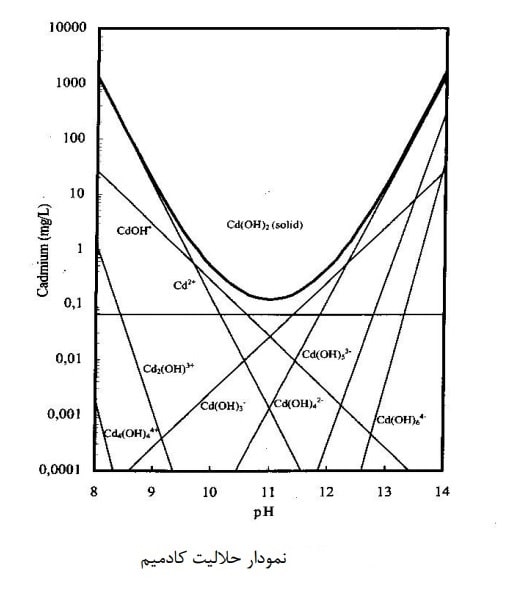
همانگونه كه در شكل بالا ديده مي شود، شكل حلاليت فلز شبيه به يك سهمي يا زنگ وارونه است. اين شكل بعضي اوقات شبيه مثلث مي گردد. در اين شكل، با افزايش ،pHحلاليت كاهش مي يابد. اين حلاليت تا يك نقطه حداقل ادامه مي يابد. پس از اين نقطه، با افزايش pH مقدار حلاليت افزايش مي يابد. نقطه حداقل حلاليت، pH بهينه ناميده مي شود. بعضي از فلزات مانند + Fe3 بخاطر حلاليت پايين محصولات توليدي چنين نموداري از خود ارائه نمي دهند و با افزايش pH حلاليت فلز بطور يكنواختي كاهش مي يابد. براي اينگونه فلزات، pHبهينه وجود ندارد. در شـكل ، حلاليت كادميوم را مي توان با يون + cd2 تعيين نمود و با نزديك شدن بـه نقطـه pH بهينه، كمپلكسهاي عمـده +،CdOH وCd(OH)o2 هستند. همانگونه كه در بالا اشاره شد، Cd(OH)o2بـه pH وابسته نيست و در تمام نقاط اطراف pHبهينه حداقل حلاليت را دارد.